オプトアウト
当教室では顎矯正治療のハイボリュームセンターである特色を生かした臨床研究を行っています。
中でも力を入れているのが、顎関節疾患の病態の解明についての研究です。近年、下顎頭吸収を伴う骨格性の咬合不全の症例が増加しています。特発性下顎頭吸収という病名でわれわれ専門家には浸透しつつありますが、その実態は不明なことが多く、臨床においても顎矯正手術を行ったにも関わらず症状が進行するなど難しいケースもあります。

若年の女性に好発するという報告が近年の統計で示されてはいるものの、下顎頭の異常吸収の原因や、なぜ年齢や性別による差が生じるのか、またどのような治療が最適であるのかなど、現時点で解明されていない点が多くあります。私たちはこれらの課題のブレイクスルーを目指して、顎矯正手術による顎関節病態や上気道に対する影響についての検討と病態解明のための基礎研究に取り組んでいます。
また、顎矯正手術後の下顎骨の形態のデータを収集し、平均的な形状の骨接合用インプラントを開発することを目的とした産学連携研究が現在進行中です。術者に優しい形状かつ生体吸収性材料を開発することで、手術精度や術後安定性のさらなる向上をはかることを目指しています。
他にも、他講座と連携した口腔外科手術における抗菌薬予防投与の研究など、より良い医療を提供できるよう日々研究に取り組んでいます。
当教室で行っている研究
基礎研究
- がんの骨破壊・骨浸潤の分子メカニズム
- 口腔がんの浸潤、転移、上皮間葉転換に関する分子生物学
- ドラッグリポジショニングによる口腔がんに対する薬物療法の研究
- 顎関節病態、とくに下顎頭吸収の病態解析
- 顎骨骨異形成症や遺伝性骨疾患の病態
- 口腔粘膜疾患に関する細胞生物学的研究
臨床研究
- 顎関節手術と顎変形症手術の併用治療に関する臨床研究
- 顎矯正手術の精度・術後安定性・顎関節病態の影響・上気道への影響に関する臨床研究
- 新たな顎矯正手術専用 生体吸収性骨接合プレートの開発
- 口腔外科手術における適切な抗菌薬予防投与の研究
- インプラント治療における骨再生療法に関する研究
口腔癌のEMT-TFによるepigeneticな制御機構の解明
口腔癌の多くを扁平上皮癌が占め、その予後は局所浸潤や転移により大きく左右されます。
現在、上皮形質を持つ癌細胞は上皮間葉転換 (EMT : Epithelial-Mesenchymal Transition) プログラムを利用して細胞運動能やアポトーシス抵抗性を獲得し、癌の浸潤・転移が進行することが広く知られています。われわれのグループでは2001年から口腔扁平上皮癌におけるEMT研究を開始し、EMT誘導マスター転写因子 (EMT-TF) Snai1を遺伝子導入することにより、口腔扁平上皮がん由来細胞株OM-1に上皮形質の喪失と間葉形質の獲得が起きることを示してきました。また、Snai1を導入したOM-1細胞の多くは上皮と間葉の形質を併せ持ったpartial EMT形質を保持しますが、われわれはpartial EMTをEMTへシフトさせる培養条件、およびEMTを上皮形質へシフト (MET : Mesenchymal-Epithelial Transition) させる培養条件をそれぞれ確立し、このモデルを用いて口腔癌の局所浸潤などの詳細なメカニズムを明らかにしてきました。
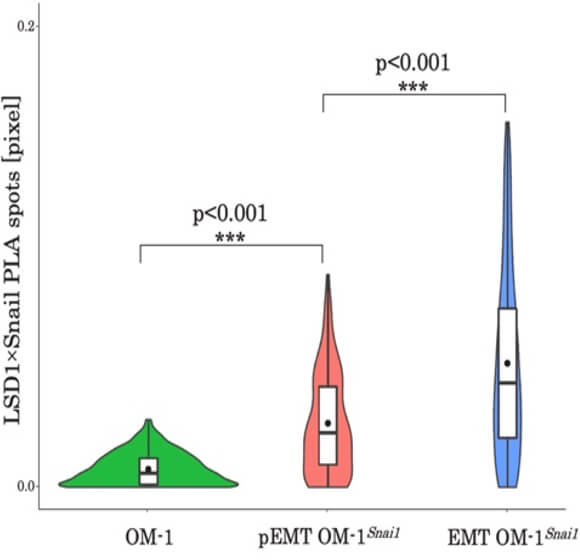
最近では、デキサメタゾンへの長期的な暴露がEMTをpartial EMTに逆変換することを報告しました。そこで、ヒストン特異的脱メチル化酵素LSD1に着目したところ、Snai1-LSD1複合体を視覚化し定量化することで、核内Snai1-LSD1複合体の数がpartial EMT-EMT 状態を代弁できることが分かりました。(図A、B)
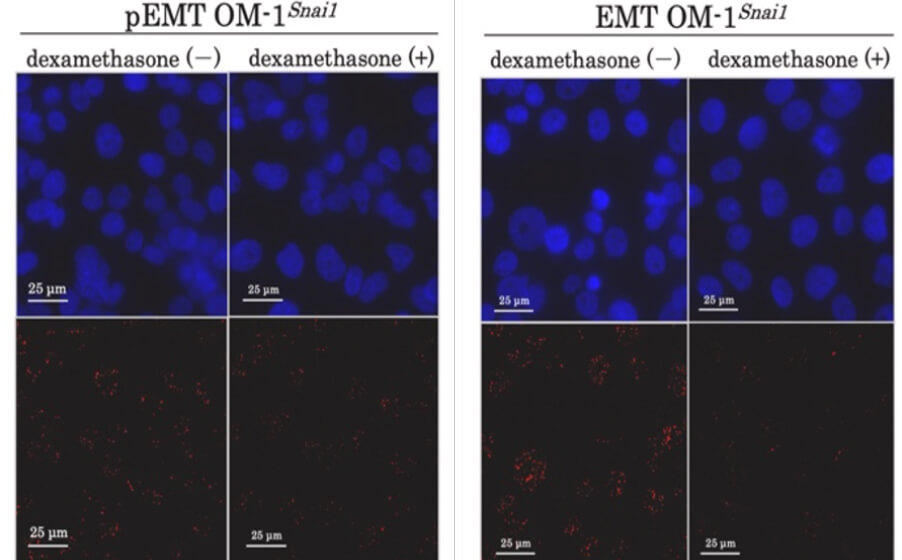
図A
図B
(Okuda et al., Biochem Biophys Rep. 2023)
また、このLSD1は腫瘍の悪性化に関与することが知られており、LSD1阻害剤は抗がん剤として期待されています。そこでわれわれは、OM-1に化学的LSD1阻害剤を添加して培養し、ZEB1の発現の状態を確認しました。すると、LSD1阻害はSnail-LSD1による上皮形質抑制を解除する一方、これと逆行した間葉形質への移行をZEB1誘導で制御することが示唆され、LSD1阻害剤の化学療法適応において不利となる側面があることを明らかにしました。(図C)
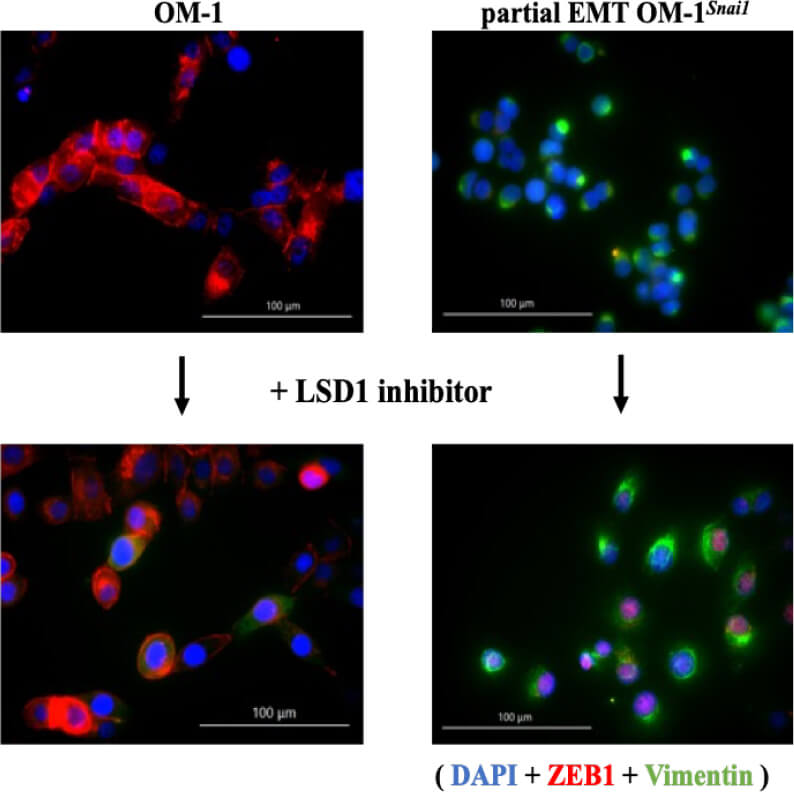
図C
(Yamakado et al. Biochem. Biophys. Res. Commun., 2023)
口腔の細胞が微生物に
対して行う免疫応答機構の解明
免疫とは病原体の感染、侵入を認識し、生体を防御するシステムのことを言います。
これまでに、われわれは口腔粘膜を構成する上皮細胞にカンジダ(真菌の一種)が感染する際、上皮細胞がβ-glucan を認識して抗ストレス遺伝子HO-1 を誘導することによって、細胞内に生じた酸化ストレスを抑制する経路を明らかにしています(図1、2)。
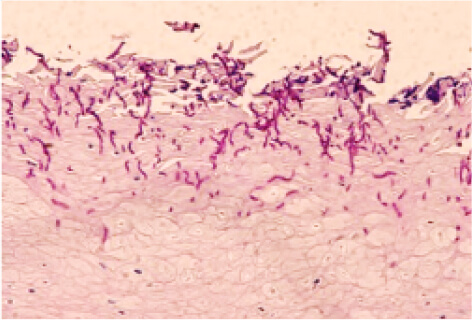
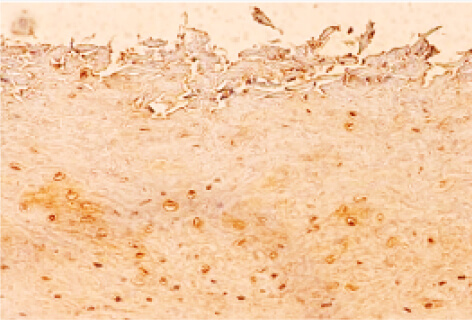
図1
(上)HE染色、(下)HO-1免疫染色
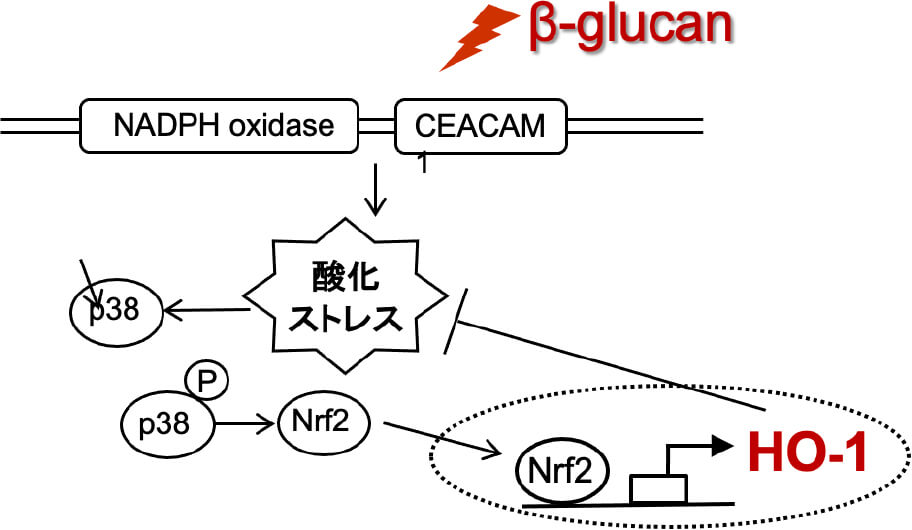
図2
Ishida Y et al. Infection and immunity, 2018 改変
近年、新型コロナウイルス(SARS-CoV-2)のスパイク蛋白の結合受容体としてACE2が同定されました。そこでわれわれは、ウイルスを模倣した2本鎖核酸を口腔粘膜上皮細胞や線維芽細胞に導入することによって、ACE2発現が誘導されることに加え(図3)、スパイク蛋白と炎症性サイトカインによって誘導される免疫応答機構を証明しました。
このように、われわれの研究グループでは口腔の細胞が細菌や真菌、ウイルスをどのように認識し,防御機構を稼働させるのか?その疑問を解明する研究を行っています。
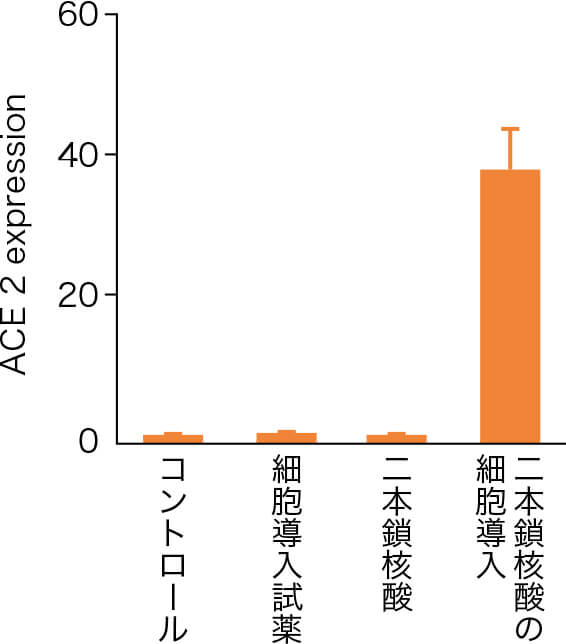
図3
Akagi M et al. Oral diseases, 2023 改変
ドラッグリポジショニング
による口腔扁平上皮癌に対する
新規抗がん剤の検討
ドラッグリポジショニングとは、ヒトでの安全性や体内動態が確認されている既存薬剤について、新たな薬効を見いだし別の疾患に対する治療薬として開発を目指す研究手法のことです。
口腔がんにおける薬物療法は長らく殺細胞性の抗がん剤が中心でしたが、分子標的治療薬であるセツキシマブが登場し、近年では抗PD-1抗体に代表される免疫チェックポイント治療薬が新たに加わり治療の幅が広がりました。
しかし、他領域の悪性腫瘍と比べ口腔がんは薬物療法において選択できる薬剤が少ない上に、治療成績が良いとは言えません。治療抵抗性の腫瘍も出現してきている中で、さまざまな作用機序の抗がん剤が必要と考えています。
がん治療のみならず、新規治療薬の創薬にはとてつもない時間がかかります。そこで、当グループではドラッグリポジショニングを用いて口腔がんに対して有効な治療薬を見出すために研究を行なっています。
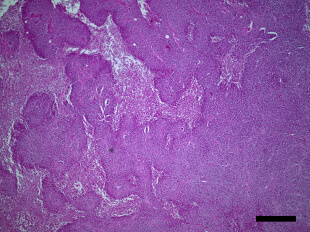
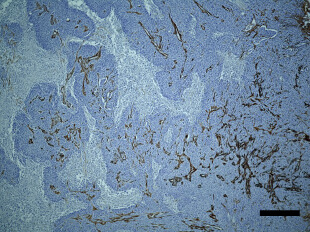
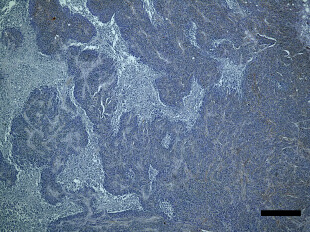
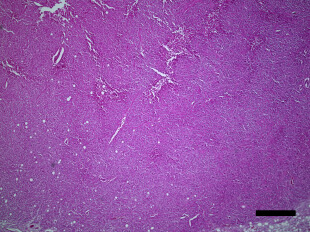
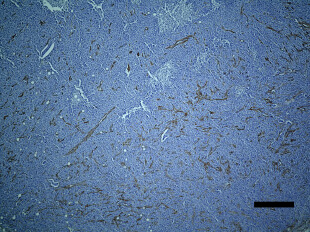
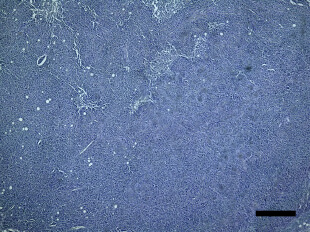
骨粗しょう症治療薬として開発されたMK-0429は、インテグリンαvβ3阻害作用を通じて骨代謝阻害作用を発揮します。われわれはインテグリンαvβ3が腫瘍血管新生を促進する作用があることに着目し、MK-0429が抗がん剤として応用可能が検討を行いました。その結果、口腔扁平上皮癌に対し、血管新生阻害作用を通じて腫瘍の抑制効果を発揮すること明らかとしました。このように、既存薬の作用機序に着目することによって、抗がん剤への応用の可能性を検討する研究を積極的に行っています。
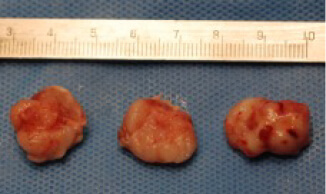
対称群
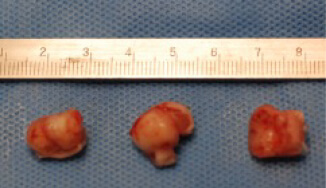
薬剤投与群
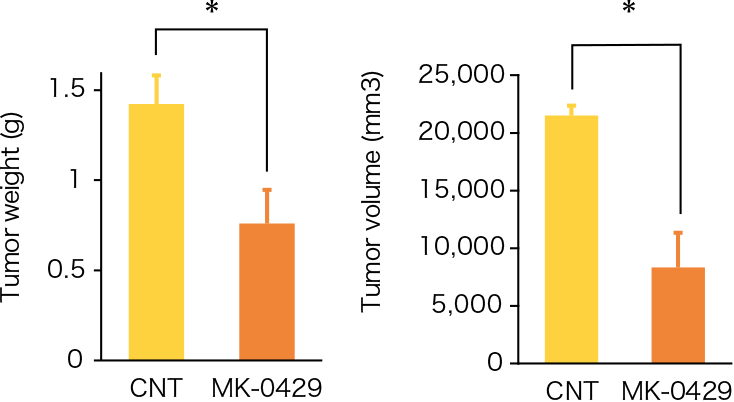
| HE | αSMA | VEGFR2 | |
|---|---|---|---|
| 対称群 |
|
|
|
| 薬剤投与群 |
|
|
|
Inhibition of angiogenesis and tumor progression of MK‐0429, an integrin αvβ3 antagonist, on oral squamous cell carcinoma
T Nakagawa et al . Journal of Cancer Research and Clinical Oncology , 2022